Generalidades y química de las proteínas
PROTEÍNAS
Las proteínas pertenecen a un grupo de macro nutrientes esenciales. Están compuesta de carbono, hidrógeno y oxígeno, son fuente esencial de nitrógeno.
A nivel biológico son de vital importancia, ya que su ingesta permite el desarrollo y cumplimiento óptimo de las funciones que se realizan en el organismo. De tal manera que, fortalecen los huesos, músculos y tejidos, incluso logra reparar los tejidos que han sido lesionados.
La hemoglobina es la proteína que llevamos en la sangre, la cual forma parte de nuestro sistema inmunológico.
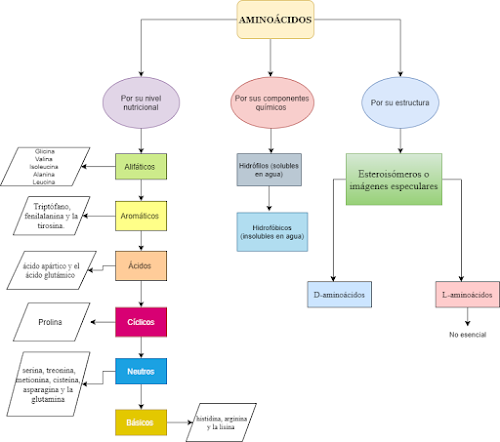
Los aminoácidos son la unidad básica de la proteína, ya que están compuestos por un grupo amino (NH₂), un grupo carboxilo (COOH) y un carbono central.
Los aminoácidos tienen grupos funcionales susceptibles a la ionización, es decir que captan o perder hidrógeno.
Cuando en el grupo amino, gana un electrón de hidrógeno, este se convierte en un catión.
Cuando en el grupo amino, pierde un electrón de hidrógeno, este se convierte en un anión.
- Alifáticos: es un hidrocarburo de cadena lateral con carácter hidrofóbico.
- Aromáticos: en su estructura presenta un anillo bencénico con carácter hidrofóbico.
- Ácidos: se ionizan negativamente debido a que pertenecen al grupo carboxilo.
- Cíclicos: su estructura es de cadena lateral alifática hidrofóbica y se forma en el organismo a partir del ácido glutámico.
- Neutros: debido a que contiene carga neutra son hidrófilos favoreciendo así, su solubilidad , es decir su carga positiva y negativa se encuentra equilibrada. Pueden formar puentes de hidrógeno sustituyendo OH por S.
- Básicos: esta compuesto de grupos amino por lo que son capaces de ionizarse positivamente.
- Aminoácidos y sus aminas
- Hidrófilos (solubles en agua)
- Hidrofóbicos (insolubles en agua)
- L-aminoácidos: forman parte de la naturaleza, no es esencial.
- D-aminoácidos, forman parte de la naturaleza biológica, lo que permite realizar distintas funciones corporales en el organismo.
 |
| |
Organización estructural de las proteínas
- Anfotéricas: tienen la capacidad de amortiguación que pueden actuar como una base o un ácido dependiendo del pH, esto le permite resistir pequeños cambios en el pH.
- Punto isoeléctrico: el pH es neutro, su carga global es cero, haciendo que las moléculas de la proteína se precipiten.
- Capacidad de retención de agua: cuando las proteínas tienen los puntos cargados y polares se unen al agua, al igual que si tienen grupos hidrófobos no se unen al agua.
- Solubilidad: algunas proteínas no se pueden dispersar en agua pura, sino en soluciones salinas diluidas.
- Temperatura: se desnaturaliza en altas T° y en bajas T° se estabilizan, entre ellos tenemos el calentamiento enfriamiento como la coagulación (exotérmico) y la gelificación (endotérmico). la degradación térmica de una enzima para incrementar la digetabilidad.
- Cambio de pH: precipitación de las proteínas, entre ellos se encuentra el requesón, yogurt, queso cottage y mozzarella
- Enzimática
- Mecánica: formación de emulsiones, tales como aire-agua (espumilla), aceite-agua (mayonesa) y agua-grasa (salchichas).


Muy buena información 👌
ResponderEliminar